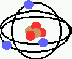
 La
BIOCHIMIE
est l'étude de la chimie des organismes vivants. Tous les atomes
sont constitués de trois composantes, les NEUTRONS, les PROTONS
et les ÉLECTRONS. Les deux premières sont situées
dans le noyaux (sphères rouges et brunes sur la figure), alors que
les électrons (sphères bleues) sont en orbite autour du noyau.
Les électrons sont toujours situés sur des ORBITALES spécifiques
situées autour de la cellule. La capacité électronique
de chacune des orbitales constitue une CONSTANTE UNIVERSELLE, et le nombre
d'électrons sur la dernière orbitale d'un atome détermine
ses CARACTÉRISTIQUES CHIMIQUES. Les orbitales à 2 et à
8 électrons sont les plus fréquemment rencontrées
en biochimie. Un atome est le plus STABLE lorsque sa dernière orbitale
est pleine. Par exemple, l'atome dont l'orbitale a une capacité
de 2 électrons mais n'en contient qu'un seul est INSTABLE et CHERCHE
a remplir cette orbitale avec un autre électron.
La
BIOCHIMIE
est l'étude de la chimie des organismes vivants. Tous les atomes
sont constitués de trois composantes, les NEUTRONS, les PROTONS
et les ÉLECTRONS. Les deux premières sont situées
dans le noyaux (sphères rouges et brunes sur la figure), alors que
les électrons (sphères bleues) sont en orbite autour du noyau.
Les électrons sont toujours situés sur des ORBITALES spécifiques
situées autour de la cellule. La capacité électronique
de chacune des orbitales constitue une CONSTANTE UNIVERSELLE, et le nombre
d'électrons sur la dernière orbitale d'un atome détermine
ses CARACTÉRISTIQUES CHIMIQUES. Les orbitales à 2 et à
8 électrons sont les plus fréquemment rencontrées
en biochimie. Un atome est le plus STABLE lorsque sa dernière orbitale
est pleine. Par exemple, l'atome dont l'orbitale a une capacité
de 2 électrons mais n'en contient qu'un seul est INSTABLE et CHERCHE
a remplir cette orbitale avec un autre électron.
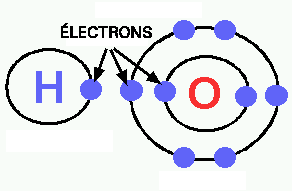
Figure 1. Schéma d'atomes d'hydrogène et d'oxygène. Ces atomes ont respectivement 1 et 6 électrons dans leurs orbitales externes. Puisque ces orbitales ont des capacités de 2 et 8 électrons, ils sont instables et cherchent à se remplir.
Lorsque 2 ou plusieurs atomes se lient, ils forment une
MOLÉCULE.
Une molécule peut être composée de plusieurs atomes
semblables ou différents. L'association stable des atomes entre
eux est une LIAISON. Il existe des
liaisons faibles et fortes. Chaque molécule possède des caractéristiques
chimiques propres qui la différencie de toutes les autres. Ci-dessous
une molécule d'eau.

Figure 2. Une molécule d'eau
Les liaisons fortes sont TRÈS STABLES et nécessitent beaucoup d'énergie pour être rompues. Les liaisons fortes sont importantes pour les organismes vivants afin de leur donner une STRUCTURE STABLE. Cependant, afin de pouvoir de croître et maintenir plusieurs processus vitaux, ces organismes doivent être FLEXIBLES. À cette fin la biochimie sera aussi basée sur un ensemble de liaisons faibles.
Le lien COVALENT est
une liaison forte qui consiste au partage d'un électron entre des
atomes, de façon à remplir leurs orbitales.
. 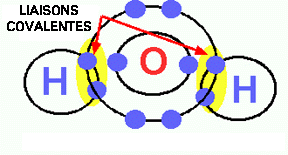
Figure 3. Liaisons covalentes de l'eau. Plusieurs molécules biologiques telles les protéines, les acides nucléiques et les lipides sont constituées par des liaisons covalentes.
Dans le cas où des atomes cèdent
des électrons à d'autres atomes, afin de compléter
leur orbitales externes, des ions positifs et négatifs sont formés.
L'attraction qui en résulte constitue une
LIAISON
IONIQUE. La liaison ionique n'est pas aussi forte que la liaison
covalente, mais elle joue un rôle important en biochimie.

Figure 4. Liaison ionique.
Un autre type de liaison entre des molécules, est
l'INTERACTION HYDROPHOBE. Ce lien se
forme entre des molécules, ou des portions de molécules,
hydrophobes afin de limiter leur contact avec l'eau.
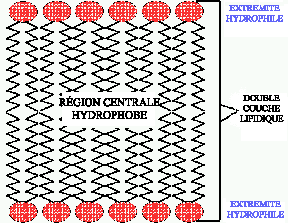
Figure 5. Interaction hydrophobe.
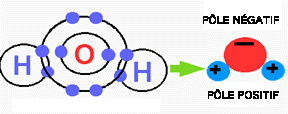
Figure 6. Molécules polaires.

Figure 7. Ponts hydrogène. Ces liens sont assez forts pour permettre par exemple à des insectes de marcher à la surface de l'eau.
Ces liaisons faibles sont essentielles au systèmes vivants. Leur rôle est illustré par l'ADN. Cette grande molécule porte l'information génétique de tous les organismes (à l'exception de quelques virus). Elle doit être à la fois STABLE pour conserver cette information intacte, et pouvoir être FACILEMENT ROMPUE afin d'être transcripte et répliquée. Les liaisons hydrogène lui permettent cette versatilité. D'une part, individuellement, le pont hydrogène est une liaison faible, facile à briser. En fait, la chaleur de notre corps est suffisante pour ce faire. D'autre part, lorsqu'il peut se former plusieurs ponts hydrogène, dans de très grandes molécules telles les protéines et l'ADN, la somme de ces liaisons faibles constituent un lien suffisamment fort pour assurer la stabilité de cette molécule.
![]() Les
GLUCIDES: mono ou disaccharides (SUCRES) et polysaccharides. Pour voir
la structure de certains sucres cliquez
ici.
Les
GLUCIDES: mono ou disaccharides (SUCRES) et polysaccharides. Pour voir
la structure de certains sucres cliquez
ici. ![]()
![]() Les
ACIDES
AMINÉS et leurs polymères, les polypeptides ou
PROTEINES . Cliquez
ici
Les
ACIDES
AMINÉS et leurs polymères, les polypeptides ou
PROTEINES . Cliquez
ici![]() pour
voir un acide aminé (le programme Rasmol est requis). Vous pourrez
y visualiser ce qu'est une chaîne latérale d'acide aminé.
pour
voir un acide aminé (le programme Rasmol est requis). Vous pourrez
y visualiser ce qu'est une chaîne latérale d'acide aminé.
![]() Les
ACIDES
NUCLÉIQUES et leurs polymères.
Les
ACIDES
NUCLÉIQUES et leurs polymères.
Cliquez ici pour des images d'acides nucléiques de format Rasmol.
![]() Les
GRAS/Lipides.
Les
GRAS/Lipides.![]() Cliquez
ici pour de l'information supplémentaire sur les gras.
Cliquez
ici pour de l'information supplémentaire sur les gras.
![]() Plusieurs
minéraux: fer, magnesium, phosphore, zinc, cuivre, etc.
Plusieurs
minéraux: fer, magnesium, phosphore, zinc, cuivre, etc.
![]() De
petites molécules organiques appelées vitamines, telles l'acide
folique, pantothénique, ascorbique, etc.
De
petites molécules organiques appelées vitamines, telles l'acide
folique, pantothénique, ascorbique, etc.
Les organismes vivants sont principalement composés
de POLYMÈRES, des chaînes aux formes variées de MONOMÈRES.
Parmi ceux-ci, on retrouve principalement les protéines, l'amidon,
le glycogène, la cellulose, les gras, les acides nucléiques.

Il existe une TERMINOLOGIE simple qui permet de distinguer la taille et la composition des biomolécules. La taille est décrite par un PRÉFIXE:
![]() POLY
signifie plusieurs;
POLY
signifie plusieurs;
![]() MONO
signifie un seul;
MONO
signifie un seul;
![]() BI, & DI, TRI, TETRA, PENTA et HEX signifient 2, 3, 4, 5 et 6 monomères
liés pour former une molécule.
BI, & DI, TRI, TETRA, PENTA et HEX signifient 2, 3, 4, 5 et 6 monomères
liés pour former une molécule.
![]() OLIGO
signifie une molécule de plus de ~6 sous-unités, mais moins
grande qu'un POLYMÈRE.
OLIGO
signifie une molécule de plus de ~6 sous-unités, mais moins
grande qu'un POLYMÈRE.
Des SUFFIXES sont souvent utilisés pour décrire le type de biomolecules:
![]() Le suffixe "OSE", réfère
à des sucres, tels glucose, fructose, sucrose, etc.
Le suffixe "OSE", réfère
à des sucres, tels glucose, fructose, sucrose, etc.
![]() Le suffixe "SACCHARIDE" réfère
à des sucres; i.e., un POLYSACCHARIDE
est une grande molécule formée de plusieurs sucres (Fig.
8). Un polysaccharide peut être composé d'un seul type de
sucre (l'amidon et le glycogène par exemple) ou de plusieurs types
différents (les lipopolysaccharides =LPS), et d'autres molécules.
Le suffixe "SACCHARIDE" réfère
à des sucres; i.e., un POLYSACCHARIDE
est une grande molécule formée de plusieurs sucres (Fig.
8). Un polysaccharide peut être composé d'un seul type de
sucre (l'amidon et le glycogène par exemple) ou de plusieurs types
différents (les lipopolysaccharides =LPS), et d'autres molécules.
![]() Le suffixe "PEPTIDE" réfère
à une molécule composée d'un minimum de 2 acides aminés.
Un dipeptide est composé de
2 ac. aminés, un tripeptide
de 3, etc. Une longue chaîne d'acides aminés est appelé
un polypeptide ou une protéine.
Le suffixe "PEPTIDE" réfère
à une molécule composée d'un minimum de 2 acides aminés.
Un dipeptide est composé de
2 ac. aminés, un tripeptide
de 3, etc. Une longue chaîne d'acides aminés est appelé
un polypeptide ou une protéine.
![]() Deux types de polynucléotides
sont présents dans toutes les cellules, l'ACIDE
DÉSOXYRIBONUCLÉIQUE (ADN)
et l'ACIDE RIBONUCLÉIQUE (ARN).
Il existe 2 différences entres l'ADN et l'ARN. Ils sont tous deux
formés d'un pentose,
mais l'ADN
est composé du pentose DEOXYRIBOSE
et
l'ARN
est
composé du pentose RIBOSE.
L'ADN
et l'ARN contiennent du phosphate et quatre bases de nucléotide.
Trois de ces bases sont les mêmes: la GUANINE
(G), l'ADÉNINE
(A)
et la CYTOSINE (C),
cependant l'ADN contient de la THYMINE
(T), alors que l'ARN contient de l'URACIL
(U). Ces bases se retrouvent presque toujours
en paires A avec T dans l'ADN ou A avec U dans l'ARN et G avec C chez les
deux acides. L'ADN et L'ARN existent sous la forme de longues chaînes.
Le squelette de cette chaîne est constitué d'une alternance
de groupements sucre et phosphate, les bases étant attachées
sur ces sucres. Normalement, mais pas toujours, l'ADN et l'ARN sont sous
la forme de DOUBLE BRINS, attachés par des PONTS HYDROGÈNES
entre des PAIRES DE BASES. L'ADN forme des paires AT et GC se faisant face
tout le long du double brin. La paire AT a deux ponts H alors que la paire
GC en a trois.
Deux types de polynucléotides
sont présents dans toutes les cellules, l'ACIDE
DÉSOXYRIBONUCLÉIQUE (ADN)
et l'ACIDE RIBONUCLÉIQUE (ARN).
Il existe 2 différences entres l'ADN et l'ARN. Ils sont tous deux
formés d'un pentose,
mais l'ADN
est composé du pentose DEOXYRIBOSE
et
l'ARN
est
composé du pentose RIBOSE.
L'ADN
et l'ARN contiennent du phosphate et quatre bases de nucléotide.
Trois de ces bases sont les mêmes: la GUANINE
(G), l'ADÉNINE
(A)
et la CYTOSINE (C),
cependant l'ADN contient de la THYMINE
(T), alors que l'ARN contient de l'URACIL
(U). Ces bases se retrouvent presque toujours
en paires A avec T dans l'ADN ou A avec U dans l'ARN et G avec C chez les
deux acides. L'ADN et L'ARN existent sous la forme de longues chaînes.
Le squelette de cette chaîne est constitué d'une alternance
de groupements sucre et phosphate, les bases étant attachées
sur ces sucres. Normalement, mais pas toujours, l'ADN et l'ARN sont sous
la forme de DOUBLE BRINS, attachés par des PONTS HYDROGÈNES
entre des PAIRES DE BASES. L'ADN forme des paires AT et GC se faisant face
tout le long du double brin. La paire AT a deux ponts H alors que la paire
GC en a trois.
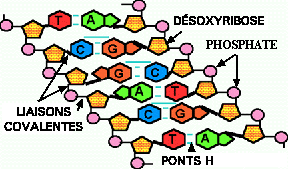
Figure 9. Une molécule d'ADN. En rose les groupements phosphate et les sucres en orange, formant le squelette de l'ADN. Les 4 bases en rouge, vert, orange et bleu sont attachées sur les pentoses et forment des paires AT et GC reliées par des ponts H (lignes bleues). Le génome humain contient approximativement 3 milliards de paires de bases.
http://www.nyu.edu:80/pages/mathmol/library/life/life.html; images 3D d'acides aminés de lipides, d'acides nucléiques, etc. (nécessite RasMol).