![]() Version originale: 11-10-96, traduite le 08-02-97
Version originale: 11-10-96, traduite le 08-02-97
![]() Version originale: 11-10-96, traduite le 08-02-97
Version originale: 11-10-96, traduite le 08-02-97
![]() 2.
Les consommateurs les plus efficaces SURVIVENT ET REPRODUISENT leurs GENES
de sorte que cet avantage est maintenu par leur progéniture. EN
AUTANT QUE L'ENVIRONNEMENT QUI A SÉLECTIONNÉ CES GÈNES
RESTE LE MÊME, les descendants de ces cellules auront un avantage
compétitif (processus de sélection naturelle).
2.
Les consommateurs les plus efficaces SURVIVENT ET REPRODUISENT leurs GENES
de sorte que cet avantage est maintenu par leur progéniture. EN
AUTANT QUE L'ENVIRONNEMENT QUI A SÉLECTIONNÉ CES GÈNES
RESTE LE MÊME, les descendants de ces cellules auront un avantage
compétitif (processus de sélection naturelle).
![]() 3.
Le métabolisme suit les lois de la thermodynamique.
3.
Le métabolisme suit les lois de la thermodynamique.
![]() 4.
Pour comprendre le métabolisme, il faut connaître ses composantes
et comment elles interagissent dans un organisme vivant.
4.
Pour comprendre le métabolisme, il faut connaître ses composantes
et comment elles interagissent dans un organisme vivant.
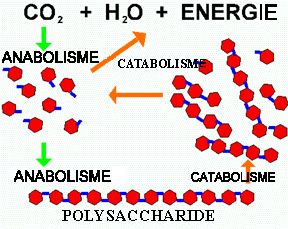
Figure 1. Anabolisme et catabolisme. Les autotrophes utilisent directement le CO2 pour produire des glucides. Ces sucres sont alors polymérisés pour former de grandes molécules telles l'amidon, la cellulose et les parois bactériennes. Ces réactions nécessitent de l'énergie qui est alors emmagasinée dans ces molécules. Quand ces macromolécules sont brisées en plus petites unités et sont finalement oxidées (catabolisme), l'énergie contenue est alors relâchée.
Une réponse très simple à ces questions
est la RÉGULATION,
à un très haut niveau, qui permet à un organisme de
contrôler le fonctionnement de chacune de ses cellules. Cette régulation
n'est possible que par la capacité des biomolécules de se
reconnaître et de s'identifier les unes aux autres. Basé sur
cette reconnaissance, ces molécules réagiront selon un programme
pré-établi. La figure ci-dessous illustre ce principe de
base.
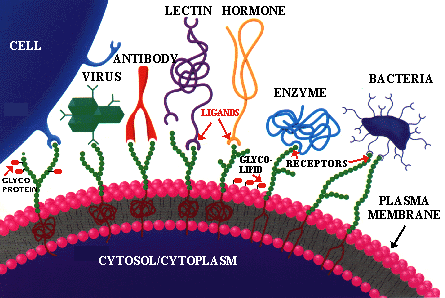
Figure 2. Le principe de la reconnaissance moléculaire. Une cellule typique contient plusieurs molécules exposées à l'environnement et en communication avec l'extérieur. Elles contiennent toutes des portions spécifiques nommées RÉCEPTEURS ou SITE D'ADHESION. D'autres molécules dans l'environnement contiennent des composantes spécifiques, des LIGANDS. Ces ligands ont la capacité de se lier uniquement à un récepteur à la surface cellulaire. Suite à cette liaison, un message (chimique) est envoyé à l'intérieur de la cellule. Ce message à son tour active le CENTRE de COMMANDE de chaque cellule afin de stimuler une série de réponse pré-programmées basées sur les informations reçues. (figure utilisée avec la permission de Sigma Chemical Co)
Les acides aminés peuvent être divisés en quatre catégories:
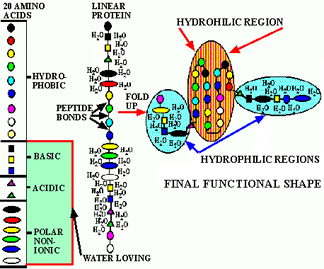
Figure 3. Stucture et composition d'une protéine. Chaque protéine est généralement repliée d'une façon caractéristique, qui lui confère son activité spécifique. En général les acides aminés non-polaires s'associent et se regroupent à l'intérieur de la protéine, alors que les acides aminés hydrophiles se retrouveront à l'extérieur de la protéine. Site internet site pour voir des protéines 3-D: Images de proteines. Pour voir une image 2-D d'une protéine se liant à l'ADN, cliquez ici.
 Les enzymes sont responsables de toutes les réactions chimiques
cellulaires. Chaque enzyme est unique et chacune n'a qu'une seule réaction
à catalyser, avec une sélectivité très élevée.
Une bactérie est comme un coffre d'outils, qui contient normalement
approx. 1000 outils (enzymes) différents et spécifiques pour
un travail précis, mais qui peut contenir jusqu'à 4000 outils
lorsque requis.
Les enzymes sont responsables de toutes les réactions chimiques
cellulaires. Chaque enzyme est unique et chacune n'a qu'une seule réaction
à catalyser, avec une sélectivité très élevée.
Une bactérie est comme un coffre d'outils, qui contient normalement
approx. 1000 outils (enzymes) différents et spécifiques pour
un travail précis, mais qui peut contenir jusqu'à 4000 outils
lorsque requis.
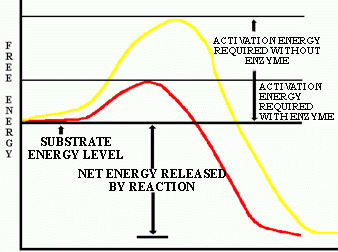
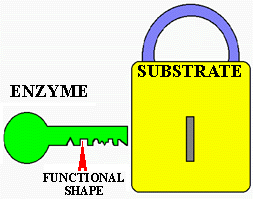
Figure 5. Analogie de la clé et de la serrure. Tout comme la clé a une forme particulière qui lui permet de n'ouvrir qu'une seule serrure, une enzyme a une forme et un site actif qui ne lui permet d'agir d'une façon unique que sur un seul substrat.
La spécificité de l'enzyme pour un substrat est telle que le changement de position d'un seul atome d'hydrogène sur la molécule-substrat peut bloquer l'interaction avec l'enzyme, et/ou la réaction. Le bon substrat s'insère toujours dans le site actif de l'enzyme. Lorsque le substrat est une grande molécule, l'enzyme peut se déformer car la stucture tertiaire (la forme) de l'enzyme est maintenue par des liaisons faibles. Remarquez par exemple comment l'enzyme EcoR1 s'est repliée autour de l'ADN, son substrat.
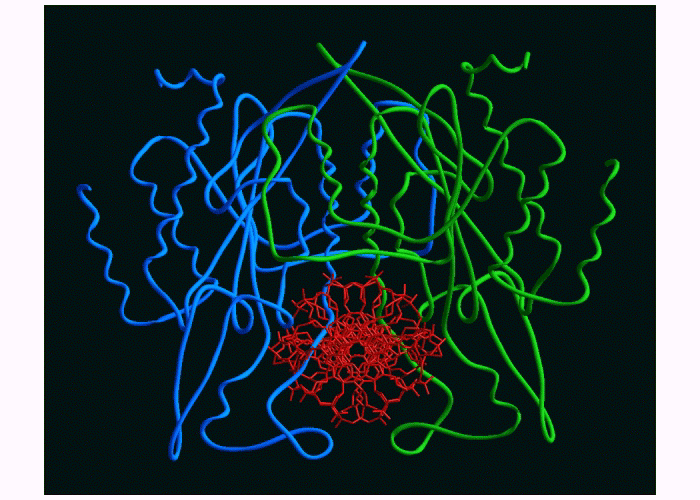
Figure 5a- L'enzyme de restriction EcoR1 autour de son substrat, une séquence spécifique d'ADN.
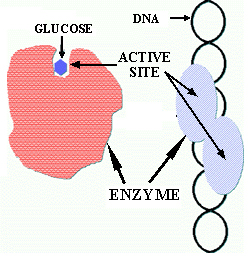
Figure 6. Rapport de taille entre l'enzyme et le substrat. Dans le case du glucose (PM=180) l'enzyme de PM approx. 40,000 est beaucoup gros. Dans le cas d'un substrat tel que l'ADN ou la cellulose, l'enzyme peut être plus petite que son substrat, mais la région sur laquelle l'enzyme agit est plus petite que l'enzyme.
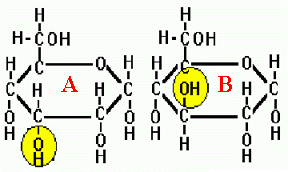
Figure 7. L'effet du changement de position d'un seul atome d'une molécule peut faire en sorte que le substrat ne sera plus reconnu par l'enzyme et donc ne réagira pas. Dans ce cas-ci, le simple le déplacement d'un groupement OH sur un sucre, passant du sucre A au sucre B, empêchera la réaction avec l'enzyme et vice versa.
L'union entre un substrat et l'enzyme est appelé
le complexe enzyme-substrat. Cliquez
ici pour voir un complexe enzyme-substrat.Ce site contient des centaines
de molécules mais est lent...
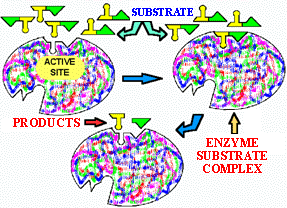
Figure 8. Le site actif d'une enzyme. Interaction, création du complexe enzyme-substrat, réaction, relarguage du ou des produits.
![]() QUESTION: Si une bactérie thermophile (adaptée à un environnement chaud) et une psychrophile
(adaptée à un environnement froid) ont toutes
les deux des enzymes qui agissent sur la même réaction chimique,
laquelle de ces enzymes abaisserait le plus l'énergie d'activation
de cette réaction et pourquoi?
QUESTION: Si une bactérie thermophile (adaptée à un environnement chaud) et une psychrophile
(adaptée à un environnement froid) ont toutes
les deux des enzymes qui agissent sur la même réaction chimique,
laquelle de ces enzymes abaisserait le plus l'énergie d'activation
de cette réaction et pourquoi?
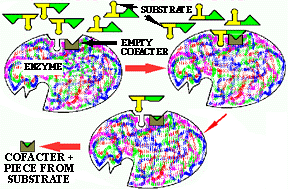
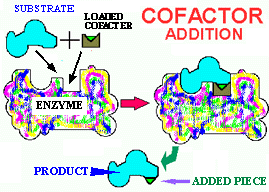
Figure 9. Coenzyme en action. À gauche, un cofacteur vide est en place dans le site actif d'un holoenzyme. Lorsque le substrat se lie au site actif, une partie en est séparée et se lie au coenzyme. Le substrat tronqué (le produit) et la coenzyme se détachent alors de l'enzyme. À droite, la coenzyme chargée se place dans le site actif d'une autre enzyme et cède la portion de la molécule transportée à un autre substrat, qui une fois modifié se sépare de cette deuxième enzyme, en même temps que la coenzyme. La coenzyme est alors prête pour un autre cycle.
Une personne manquant d'une vitamine ou d'un minéral
ne peut survivre et ultimement mourra. Cependant, ce processus peut être
long puisque en général les cofacteurs ont une longue durée
de vie et qu'une quantité infime seulement est requise. Les cofacteurs
métalliques sont souvent dénommés ÉLÉMENTS
TRACE. Les autres composantes du milieu de culture et la verrerie utilisée
pour le préparer (le milieu) en contiennent souvent suffisamment
pour satisfaire aux besoins des microorganismes. Lors de l'étude
du métabolisme du fer, les milieux de culture et la verrerie doivent
être traités de façon a éliminer toute trace
de fer, sans quoi les effets de la carrence en fer ne peuvent être
observés.
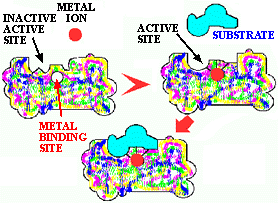
Figure 10. Effet du groupe prosthétique. Ici, le site actif ne peut être correctement conformé à moins qu'un ion métallique ne soit en place.
Les plantes et les animaux sont plus vulnérables aux carence en vitamines et minéraux. L'être humain est une des rares formes de vie qui ne synthétise pas sa propre vitamine C. La vitamine C a une courte demie-vie et nécessite un apport constant. La carence en vitamine C peut entraîner le scorbut, maladie fréquente aux débuts de la colonie.
Les enzymes peuvent aussi être désactivées,
ou inhibées, par certaines molécules appelées inhibiteurs
enzymatiques. Il existe deux catégories importantes d'inhibiteurs
enzymatiques, soit les inhibiteurs COMPÉTITIFS
ou
NON-COMPÉTITIFS. Les inhibiteurs
compétitifs sont des molécules qui ressemble suffisamment
au vrai substrat de l'enzyme pour occuper son site actif, mais sans y réagir.
Ses substances ANALOGUES accaparent
les sites actifs normalement utilisés par le vrai substrat et entrent
donc en compétition avec ce dernier. Ce genre de produit chimique
peut être utilisé pour affecter des enzymes vitales de pathogènes
afin de les enrayer. Par exemple, l'AZT bloque un enzyme important du VIH;
les sulfamidés (antibiotique) ressemblent au p-aminobenzoate (PABA),
un substrat impliqué dans la formation de l'acide folique, une vitamine;
la péniciline bloque une enzyme bactérienne essentielle pour
la formation d'une liaison du peptidoglycane.
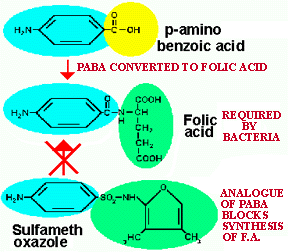
Figure 11. L'acide folique est essentiel pour plusieurs bactéries. Les sulfamidés sont des analogues du PABA, un précurseur de l'acide folique. Les enzymes responsables de la transformation du PABA sont empoisonnés par les sulfamidés et perdent leur capacité de synthétiser l'ac. folique. Les humains ont aussi besoins d'acide folique mais ne sont pas affectés par les sulfamidés. Pourquoi? Le gouvernement américain (3-96) a récemment autoriser l'ajout d'acide folique à plusieurs aliments afin de réduire l'incidence des diformités foetale. Toutes les jeunes femmes enceintes devraient prendre des suppléments d'acide folique.
L'inhibiteur allostérique s'insère dans le site allostérique par le même mécanisme de clé et serrure que le substrat dans le site actif. Cependant, le site allostérique est distinct du site actif, n'étant pas situé au même endroit sur la protéine. L'effet allostérique agit généralement sur l'activité en modifiant la forme du site actif. Plusieurs effecteurs allostériques peuvent agir sur la même enzyme par des sites allostériques différents. Les effecteurs peuvent aussi permettre la conformation correcte de sites actifs, on parle alors d'effecteurs allostériques positifs. La diminution de l'activité enzymatique par effet allostérique sera plutôt due à un effecteur allostérique négatif.
Il est important de retenir que la formation du complexe
enzyme-molécules allostérique est réversible. La formation
de ce complexe est le produit de deux facteurs: 1) la concentration de
la molécule allostérique et 2) la force d'attraction (l'affinité)
entre la molécule allostérique et le site allostérique.
Si la concentration en effecteur est faible, la probabilité qu'il
se lie au site allostérique sera faible et l'enzyme sera peu inhibée.
Mais si l'attraction site/effecteur est grande, à une concentration
d'effecteurs donnée, un plus grand nombre de sites allostériques
seront occupés et l'effet inhibiteur sera plus important.
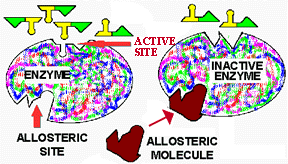
Figure 12. Effet allostérique
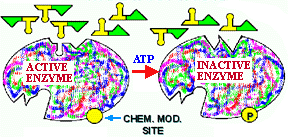
Figure 13. Régulation enzymatique par modification chimique.
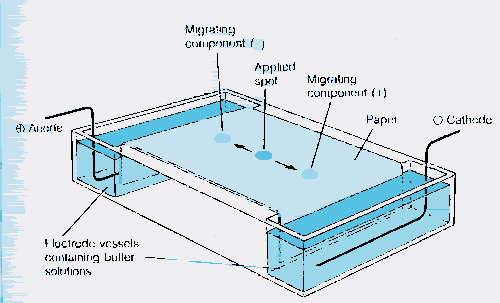
Figure 13a: Electrophorèse
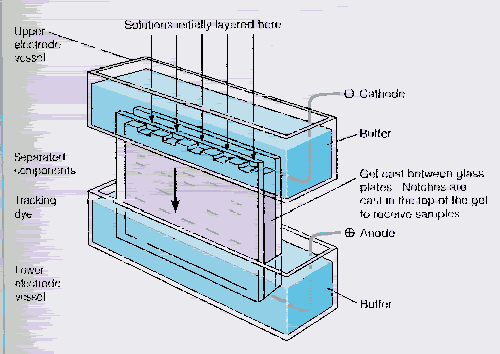
Figure 13b: Électrophorèse
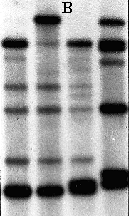
Figure 13c: gel d'électrophorèse.
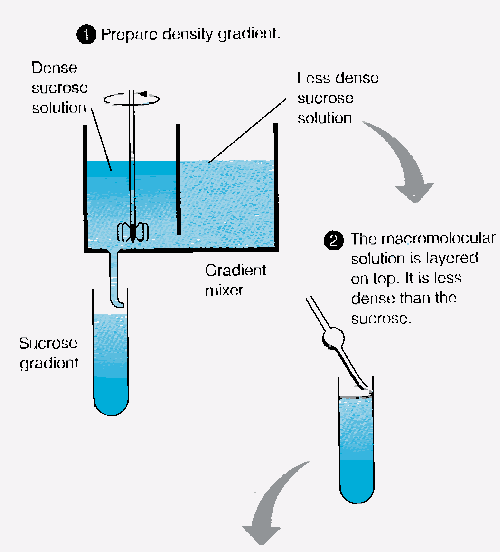
Figure 13d. Séparation par gradient de densité
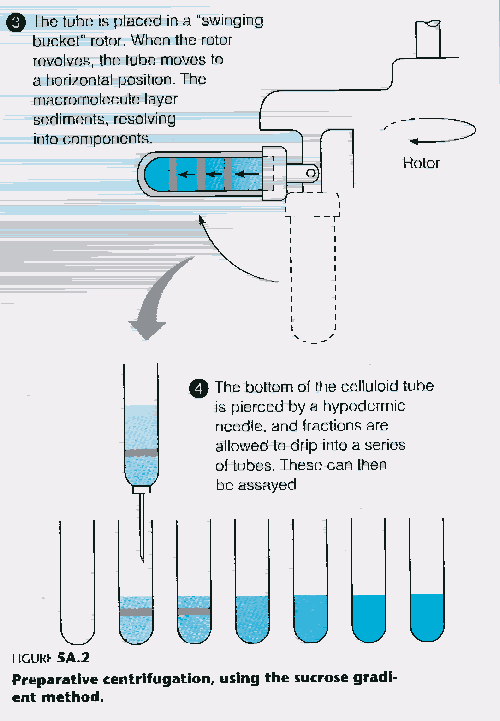
Figure 13e. Séparation par gradient de densité (suite)
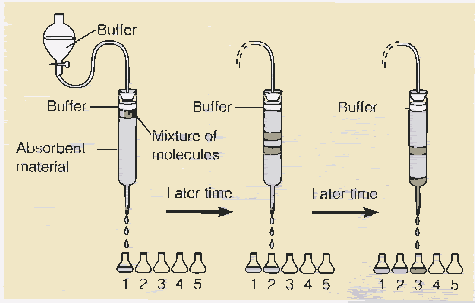
Figure 13f. Séparation par colonne de chromatographie
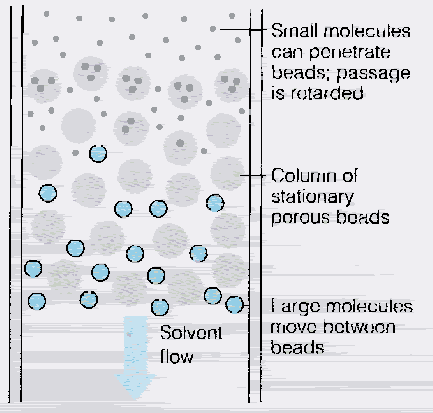
Figure 13g. Principe de la filtration par gel
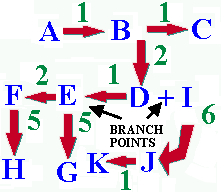
Figure 14. Illustration d'une série de voies métaboliques inter-reliées. Les lettres bleues représentent les substrats étant transformés par les enzymes. Le nombre d'enzymes requises pour convertir un substrat en un produit donné est indiqué en vert. La cellule doit réguler la concentration des produits en tous points. Par exemple, si la cellule a besoin de beaucoup de C, mais pas de G ou H, et juste un peu de K, les flux de substrats s'ajusteront en conséquence.
Bien que la plupart des voies métaboliques soient connues, certaines voies spécialisées restent mystérieuses, telles que celles responsables de la synthèse de certains antibiotiques. La grande partie de la recherche actuelle porte sur la régulation de l'activité et de la synthèse enzymatiques. Par exemple, toutes les cellules dans le corps humain contiennent l'ensemble des gènes humains, cependant seulement une petite partie de ces gènes sont actifs dans une cellule donnée. La spécialisation des activités cellulaires ainsi que le développement d'un individu à partir d'une paire de cellules sont des processus encore mal compris. La découverte des mécanismes par lesquels certains jeux de gènes spécifiques sont activés ou réprimés, dans le temps et l'espace, reste un défi majeur fantastique pour les chercheurs.
Cliquez ici pour une excellente présentation d'une voie métabolique importante: la glycolyse. Cliquez ici pour un choix de voies métaboliques à observer.
On retrouve des micro-organismes photosynthétiques ches les eucaryotes et les procaryotes. Les deux emploient une variation de la chlorophylle, une molécule contenant du magnésium qui capte la lumière. Plusieurs organismes utilisent des pigments accessoires pour absorber certaines parties du spectre lumineux et les transférer à la chlorophylle. On peut observer ces pigments accessoires sur les feuilles en automne. Chez les procaryotes, les pigments accessoires masquent souvent la chlorophylle, donnant à ces organismes une variété de couleurs telles le brun, plusieurs rouges, violets, jaunes, bleus et verts. LA majorité des procatyotes photosynthétiques sont anaérobies obligatoires et ne produisent pas d'oxygène comme sous-produit de la photosynthèse. Cependant, un groupe important, les CIANOBACTÉRIES sont OXYGÉNIQUES (produisent de l'oxygène). Il y a des preuves solides à l'effet que ces bactéries seraient à l'origine de la formation de l'oxygène moléculaire sur notre planète. Il est aussi fort probable que les chloroplastes des plantes vertes proviennent des cyanobactéries, devenues organelles chez ces grandes cellules.
Les eucaryotes et les procaryotes OXYDENT les molécules riches en énergie pour obtenir de l'énergie. L'oxydation consiste à arracher une paire de proton/électron de ces molécules riches et de les donner à l'atome d'oxygène pour former de l'eau, en relâchant l'énergie contenue et en la capturant dans une molécule organique, l'adénosine triphosphate, ou ATP. L'ATP est la batterie de tout organismes vivants. Lors de la photosynthèse, l'énergie est aussi convertie en ATP. L'ATP contient une chaîne de 3 molécules de phosphate. Les liens entre les deux derniers phosphates sont RICHES EN ÉNERGIE et cette énergie peut être relâchée par des enzymes d'une manière contrôlée de façon a construire les macromolécules nécessaires à la vie de la cellule. L'ATP fournit l'énergie pour les processus ANABOLIQUES. L'ATP est une petite molécule qui peut se déplacer facilement dans la cellule. Elle est aussi stable (on peut conserver de l'ATP sous forme de poudre durant des années au congélateur), mais pas trop stable. POURQUOI?.
Comme vous devez le savoir, les enzymes qui font ou utilisent
l'ATP ont des sites actifs pour la liaison de l'ATP de façon a utiliser
leur énergie. Lors de la synthèse de l'ATP, une molécule
de phosphate est ajoutée à l'ADP (adénosine diphosphate)
par un processus appelé la PHOSPHORYLATION (ADP + phosphate + énergie
= ATP).
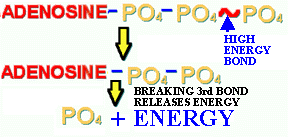
Figure 15. L'adénosine triphosphate (ATP), la monnaie d'échange énergétique de la cellule. Cliquez ici pour voir un dessin animé de l'ATP.