En 1884, C. Chamberland, de l'équipe de Pasteur, découvrit que les bactéries pouvaient être COMPLÈTEMENT RETENUES par le passage d'un bouillon de culture dans un filtre en céramique poreuse, et que le liquide passant au travers de ce filtre (le FILTRAT) était stérile. Cette méthode a alors été employée pour la stérilisation de solutions contenant des composants sensibles à la chaleur. En contrôlant la composition de ces filtres en céramique, l'on pouvait contrôler la taille des pores et ainsi séparer des particules selon leur taille.
Ce moyen est aussi devenu rapidement une manière
de démontrer la théorie des germes, puisque en faisant passer
un échantillon infecté dans le filtre, le filtrat ne devait
pas entraîner de maladie dans un nouvel hôte. On pu aussi alors
penser à une façon pour cultiver un pathogène potentiel.
Cependant, en 1892, D. Iwanowski parvint à de bien curieux résultats
alors qu'il tentait de filtrer des extraits de plantes souffrant de la
mosaique du tabac. Le filtrat était tout à fait capable d'induire
la maladie originale chez de nouveaux hôtes. Après de nombreux
essais menant toujours aux mêmes résultats, alors que rien
ne pouvait être cultivé à partir du filtrat et que
rien ne pouvait y être observé, même avec les plus puissants
microscopes, Iwanowski et ses collaborateurs ont conclu qu'ils avaient
découvert un nouveau pathogène qu'ils désignèrent
du nom pas très original de "VIRUS FILTRABLE".
Nous savons maintenant que les virus ont des tailles variant entre 20 nm
et 250 nm. Nous savons aussi que certaines des plus petites bactéries
telles les chlamydiae et les mycoplasmes sont presque aussi petits que
les plus grands virus et que eux aussi peuvent passer au travers de filtres
qui retiennent autrement 99% des types de bactéries.
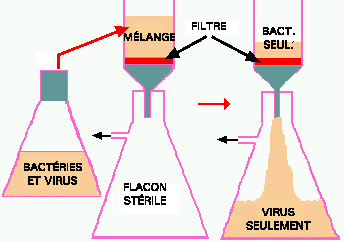
Figure 1. Filtration d'un mélange de bactéries et de virus. Les virus passeront à travers le filtre alors que les bactéries seront retenues. La bière est filtrée par un procédé semblable.
Vers 1900, des maladies telles que la maladie des pieds
et de la bouche (vache), certains cancers animaux ainsi que la fièvre
jaune humaine avaient été reliés à la présence
de virus filtrables. La communauté scientifique savait alors qu'elle
faisait face à un nouveau type de dangereux pathogènes. Le
termes VIRUS a alors été associé de façon permanente
à cette forme de vie. Bien que certaines formes de virus bactériens,
les bactériophages, ai été découvert en 1915
& 1917, les virus n'ont pas été observés avant
le développement de la microscopie électronique à
la fin des années 1930.
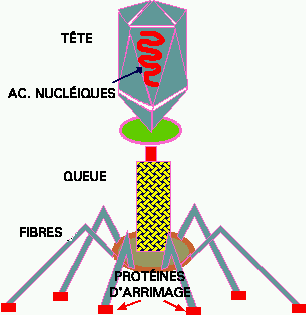
Figure 2. PHAGE T-PAIR. Un des grands bactériophages et un des virus les plus complexes. À l'opposé, certains phages sont très petits et ne contiennent que 7 gènes. Ce phage d'E. coli a beaucoup été étudié et est bien connu.
Nous savons maintenant qu'il existe des virus capables d'attaquer toutes les formes de vie sur cette planète. De nouveaux virus sont découverts régulièrement, et la plupart des virologistes pensent que nous n'avons jusqu'à maintenant découvert que la pointe de l'iceberg. Par exemple, lorsque l'on observe de l'eau de mer au microscope électronique, l'on peut voir une multitude de particules ressemblant à des virus alors que peu d'informations sont disponibles sur leur origine, leur constitution ou leur hôte potentiel.
La nature des virus a encore été plus énigmatique lorsque, en 1935, il a été observé qu'ils pouvaient être CRISTALLISÉS comme des sels organiques ou des protéines. Cette observation est à l'origine du débat sur la nature " vivante" ou "inerte" des virus. Les virus ne sont généralement pas considérés comme vivants, étant donné qu'ils ne réunissent pas toutes les conditions énumérées au début du chapitre 2. Cependant, une chose est certaine, les virus répliquent leur matériel génétique qui est composé, comme toutes les formes de vie, de polymères d'acides nucléiques.Les virus ont une caractéristique en commun: ce sont des parasites intracellulaires obligatoires. Les virus sont incapables de croître et se reproduire à l'extérieur d'une cellule vivante. Leur survie dépend donc absolument de la survie de leur hôte, ce qui semble contradictoire avec la nature pathogène de certains virus qui plus souvent qu'autrement tuent leurs victimes. Qu'en pensez-vous?
La nature intracellulaire des virus a posé un défi aux chercheurs qui devaient cultiver les cellules hôtes pour pouvoir faire croître le virus. Il a été possible d'isoler suffisamment de matériel à partir de virus de plantes ou de bactéries pour en faire l'analyse. Ces études ont montré que les virus étaient essentiellement COMPOSÉS DE PROTÉINES ET D'ACIDES NUCLÉIQUES. Pour les virus d'eucaryotes, la recherche n'a pas pu avancer plus rapidement que les recherches en CULTURE TISSULAIRE. La première percée dans ce domaine a eu lieu en 1931, alors qu'on a découvert que l'on pouvait se servir d'un oeuf de poule fertilisé comme "plat Petri" pour la culture de certains virus. Cette technique a donné lieu aux premières cultures artificielles de virus pour la production de vaccins. Encore aujourd'hui, plusieurs virus sont cultivés dans des oeufs, dû au faible coût et au fait que c'est une méthode éprouvée. Avez vous jamais entendu un docteur demander avant de donner un vaccin: " êtes-vous allergique aux oeufs?" ce qui signifie que le virus a été produit dans des oeufs et que les protéines de l'oeuf (auxquelles plusieurs personnes sont allergiques) sont présentes dans le vaccins.
On peut trouver des micrographies ou images de virus aux adresses internet suivantes:
http://medix.mmi.uct.ac.za/~jmoodie/linda.html Bonne photo de microscopie électronique. Problèmes occasionnels pour les obtenir.
http://medix.mmi.uct.ac.za/~jmoodie/virarch.html Explique l'architecture virale. photos.
http://www.bocklabs.wisc.edu/virusviz.html Plusieurs photos intéressantes.
http://boris.qub.ac.uk/vsd/vsd6f.html Plusieurs très bonnes photos.
http://outcast.gene.com/ae/WN/NM/murphy_EMs.html; Virus de l'Ebola et plusieurs autres.
http://www.tulane.edu/~dmsander/garryfavweb.html; Vaste collection de photos, cours, etc.
Tous les virus sont recouvert d'une COUCHE PROTÉIQUE. Cette couche est principalement composé que d'un seul type de protéine à plusieurs exemplaire. Ces sous-unités protéiques identiques sont appelés CAPSOMÈRES et s'auto-assemblent spontanément selon un patron pré-déterminé afin de former la CAPSIDE.
Si un virus n'a qu'une capside, il est appelé VIRUS
NU. Dans certains cas, le virus arrache une membrane lipidique
à son hôte et s'en recouvre. La membrane lipidique est alors
appelée ENVELOPPE et un tel virus est appelé VIRUS
ENVELOPPÉ. Tous les virus contiennent un autre type de
protéines: ce sont les
PROTÉINES
D'ADHÉSION (PA). La protéine d'adhésion
est nécessaire au virus pour s'ATTACHER À SA CELLULE CIBLE
avant d'y pénétrer. De toute évidence, cette protéine
doit être située à la surface externe et se projeter
le plus loin possible du virus afin de pouvoir entrer en contact avec UN
RECEPTEUR à la surface de la cellule cible (hôte). Le virus
peut aussi contenir une certaine quantité de glucides (glycoprotéines).
Un exemple de ces deux types de virus est illustré ci-dessous.

Figure 3. Un virus nu. Les sphères rouges représentent les sous-unités protéiques, les capsomères, constituant la capside.

Figure 4. Un virus enveloppé. Une membrane lipidique entoure la capside protéique. Cette enveloppe est composée de membrane cellulaire à l'intérieur de laquelle le virus s'est répliqué, de protéines et de glucides. Certaines protéines peuvent provenir de la cellule hôte.
![]() Les virus de la variole et du SIDA attaquent seulement l'homme.
Les virus de la variole et du SIDA attaquent seulement l'homme.
![]() Le bactériophage lambda attaque uniquement les cellules qui contiennent
le recepteur pour lier le sucre maltose.
Le bactériophage lambda attaque uniquement les cellules qui contiennent
le recepteur pour lier le sucre maltose.

Figure 5. Bacteriophage se liant et injectant son ADN dans une cellule bactérienne.
![]() Le virus de l'influenza peut vivre dans les canards, les cochons, et les
humains.
Le virus de l'influenza peut vivre dans les canards, les cochons, et les
humains.
Figure 5a. Adenovirus et leurs fibres
Le principe de base de l'infection virale d'une cellule donnée est que si la SURFACE EXTERNE de cette cellule contient le RÉCEPTEUR auquel la PROTÉINE D'ADHÉSION peut se lier, le virus va être capable de l'envahir et de croître dans cette cellule. Ceci ne s'applique uniquement qu'aux espèces reliées ou à différents types de cellules à l'intérieur d'un hôte. Par exemple, le phage lambda n'envahira naturellement que quelques espèces de Gram négative, mais si vous ajoutez un plasmide dans une cellule G+ qui contient le gène pour le récepteur lambda, alors le lambda peut se lier et injecter son ADN dans cette cellule (voir ci-dessous). Un autre exemple est celui de la grippe commune. Ces virus sont spécifiques aux cellules des voies respiratoires supérieures humaines, parce qu'ils ont une PA spécifique à un récepteur sur ces cellules. Certains autres virus qui causent certaines maladies intestinales se lient uniquement à certains récepteurs des cellules de l'intestin; D'autres ne se lient qu'à des récepteurs des cellules du foie et causent l'hépatite, alors que d'autres encore, tel l'herpes, se lient uniquement à des récepteurs de cellules nerveuses.
![]() Adsorption ou "ARRIMAGE" avec le récepteur
de la cellule hôte.
Adsorption ou "ARRIMAGE" avec le récepteur
de la cellule hôte.
![]() Entrée ou PÉNÉTRATION
de l'acide nucléique viral dans le cytoplasme de l'hôte.
Entrée ou PÉNÉTRATION
de l'acide nucléique viral dans le cytoplasme de l'hôte.
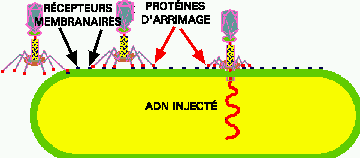
Figure 6. Adsorption et pénétration. Le phage se lie aux récepteurs de la cellule hôte (points noirs) via ses protéines d'adhésion (points rouges) au bout de ses fibres. Une fois solidement arrimé à la cellule, un enzyme viral perce un trou dans la paroi cellulaire de l'hôte, la base de la queue du virus s'appui sur la paroi et l'ADN viral est injecté dans le cytoplasme de l'hôte. Dans le cas des phages, la capside virale reste à l'extérieur, mais dans le cas des virus d'eucaryotes, le virus entier peut être intégré dans le cytoplasme de la cellule hôte.
![]() BIOSYNTHÈSE
des composantes virales.
BIOSYNTHÈSE
des composantes virales.
![]() Assemblage (MATURATION) des composantes
virales en une unité virale complète.
Assemblage (MATURATION) des composantes
virales en une unité virale complète.
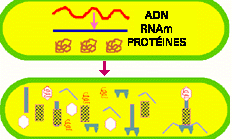
Figure 7. Synthèse des composantes virales. Une fois à l'intérieur de l'hôte, le génome viral prend le contrôle du métabolisme cellulaire, le mettant à son service. L'acide nucléique viral est transcrit et traduit et les protéines virales, enzymatiques ou structurelles, servent à produire de nouvelles particules. Chez plusieurs phages, le cycle entier, de l'adsorption à la lyse cellulaire dure entre 20 et 40 minutes.
![]() RELARGAGE
du virus complet par la cellule hôte.
RELARGAGE
du virus complet par la cellule hôte.
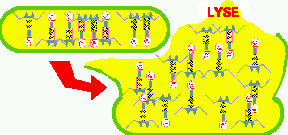
Figure 8. Maturation et relargage des phages. Les composantes s'accumulent et s'assemblent spontanément à l'intérieur de la cellule, pour former de nouveaux phages. C'est un processus ordonné où chaque composant est produit et assemblé selon une séquence précise. À la fin, des enzymes sont produits qui ont pour fonction de faire lyser ou éclater la cellule, permettant le relâchement simultané de tous les virus produits.
Certains bactériophages sont parmi les virus les plus grands et les plus complexes. Les Figures 5 à 8 illustrent le cycle de reproduction d'un de ces phages, le T-pair. Ces phages ont une tête, une queue, une plaque basale et des fibres de queue, tel qu'illustré à la Figure 2.
En l'absence d'un hôte, les longues fibres sont enroulées autour de la queue, mais lorsque la présence d'un hôte est perçue par le phage, les fibres se déroulent et s'étendent, augmentant la surface potentielle de contact avec l'hôte. Le bout des fibres de queue sont composées de PROTÉINES D'ARRIMAGE. Lorsqu'une ou plusieurs de ces protéines contacte une PROTÉINE-RÉCEPTEUR sur l'hôte, elles adhèrent fortement l'une à l'autre, amenant rapidement les autres fibres à entrer en contact avec d'autres récepteurs, attachant la queue du virus à la paroi externe de l'hôte.
Cet adhésion initie une série d'évenements: formation d'un orifice dans la paroi cellulaire par le lysozyme viral, contraction des fibres de queue causant l'entrée de la queue dans le cytoplasme, puis injection de l'ADN viral de la tête du phage dans le cytoplasme de l'hôte.
Une fois dans le cytoplasme, l'ADN VIRAL PREND CONTRÔLE DE LA CELLULE. Il produit une nucléase spéciale qui fragmente l'ADN de l'hôte en de petits segments inopérants, rendant la cellule disponible pour la production des protéines virales, par la transcription et la traduction de l'ADN du virus. Les ribosomes, les nutriments et les réserves d'énergie de la cellule sont utilisés par le virus pour se reproduire.
Les enzymes viraux manufacturent de nouveaux composants de phages en grandes quantités, qui s'accumulent dans le cytoplasme. Puis, des protéines sont formées qui interviennent dans le processus de maturation. Plusieurs des composants phagiques sont auto-assemblables, c'est à dire qu'ils vont spontanément se lier selon un patron prédéterminé pour former la tête (capside), la queue et les fibres des nouveaux phages.
Une fois les phages matures complètement assemblés et prêts à commencer une nouvelle vie, la cellule est lysée ou rupturée par une enzyme virale et les phages sont relâchés dans l'environnement.

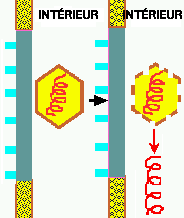
Une fois dans le cytoplasme, la capside est ouverte et le génome viral est relâché dans le cytoplasme. Selon la nature du virus, le génome viral peut rester dans le cytoplasme ou entrer dans le noyau avant de commencer à se reproduire.
Dans le cas de l'ENDOCYTOSE,
le processus initial d'adhésion est le même, mais plutôt
que de se fusionner avec la membrane celulaire, le virus stimule la cellule
à le phagocyter entièrement. Ce processus est illustré
ci-dessous.
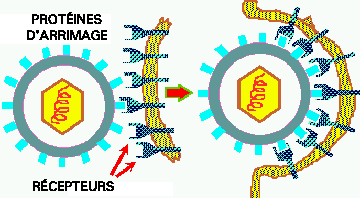


Figure 10. Entrée par endocytose d'un virus eucaryote.
Une fois dans le cytoplasme, le virus est tout d'abord dans une vésicule. Par la suite les deux membranes lipidiques de la vésicule fusionnnent, relâchant le virus et sa capside. La capside est ensuite éliminée et le génome viral prêt à se répliquer.
Le processus détaillé de biosynthèse et de maturation est très différent d'un type de virus à l'autre. Cependant, essentiellement, le matériel génétique viral prend le contrôle du métabolisme cellulaire pour ses propres fins. De l'ARN est produit qui fabrique à son tour des protéines virales. Les protéines virales produisent les composantes de nouveaux virus, ces composantes sont assemblées et le génome viral est empaqueté dans une capside virale. Finalement, les virus matures ou VIRIONS sont relâchés dans l'environnement et un nouveau cycle commence.
La réplication du virus nu est moins élaborée, mais suit les mêmes étapes. Après l'adhésion aux récepteurs cellulaires, le virus nu pénètre dans le cytoplasme de l'hôte, le génome est libéré et la réplication virale s'amorce.
La Figure 11 montre la maturation et le relâchement d'un virus enveloppé. Le processus par lequel le virus eucaryote enveloppé prend une portion de la membrane cellulaire en sortant de la cellule est appelé bourgeonnement. Par exemple, le virus HIV sort de la cellule par bourgeonnement. Que la sortie des virus impliquent la lyse ou le bourgeonnement, la cellule finit par mourir de l'infection virale étant donné la destruction de son propre métabolisme.
Dans certains cas cependant, une infection virale ne mène
pas toujours à la mort à court terme de la cellule hôte.
Une infection persistante lors de laquelle les virus sont produits sur
une longue période de temps est possible. Dans d'autres cas, un
virus peut causer une modification de la cellule (transformation) puis
disparaître. Finalement, d'autres virus peuvent demeurer sous une
forme
latente durant une longue période, pour se ré-activer
par la suite. Par exemple, connaissez-vous quelqu'un qui a déjà
souffert du zona? Plusieurs d'entre vous vont souffrir de cette maladie
durant leur vie. C'est un cas de virus latent, le virus de la varicelle,
qui se loge dans les noyaux des neurones sensoriels des ganglions dorsaux,
et qui peut se ré-activer sous la pression d'un stress psychologique
ou physiologique, ou encore en cas d'immuno-supression.
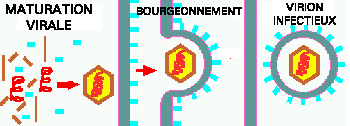
Figure 11. Maturation et relargage d'un virus par bourgeonnement au travers de la membrane plasmique. Cette illustration montre un nouveau virus enveloppé arrachant une portion de la MP lors du bourgeonnement hors de la cellule hôte. Remarquez la présence de protéines d'arrimage virales dans l'enveloppe (bâtonnets bleus).
Certains virus utilisent de l'ARN comme code génétique, ce qui implique des mécanismes spéciaux de transcription inverse et de traduction de leur part, puisque le processus normal de transcription se déroule de l'ADN vers l'ARNm. La découverte de ces mécanismes a aussi permis de comprendre l'étiologie de certains cancers, du SIDA et d'autres maladies virales.
![]() Identification d'une cellule hôte adéquate pour la croissance
du virus sous étude.
Identification d'une cellule hôte adéquate pour la croissance
du virus sous étude.
![]() Croissance de cet hôte en une monocouche
cellulaire sur une surface solide.
Croissance de cet hôte en une monocouche
cellulaire sur une surface solide.
![]() Inoculation du virus d'intérêt sur les cellules; ajustement
de la quantité de virus utilisée de sorte que chaque cellules
soit infectée par un maximum de un virion.
Inoculation du virus d'intérêt sur les cellules; ajustement
de la quantité de virus utilisée de sorte que chaque cellules
soit infectée par un maximum de un virion.
Les virus en se répliquant vont former une série de cercles concentriques, libres de cellules, appelés des plages de lyse (plaques en anglais), grossissant au fur et à mesure de la propagation virale. Ces plages peuvent être observées et comptées à l'oeil nu, de sorte que l'on peut estimer une concentration virale (titre viral).
L'étude des phages est relativement facile par
cette méthode. On ne peut pas en dire autant pour les virus eucaryotes,
puisque les cellules eucaryotes sont difficiles à cultiver. Elles
poussent lentement, ce qui les particulièrement vulnérables
à la contamination par des procaryotes, nécessitent des milieux
complexes et dispendieux ainsi que des équipements spéciaux.
Finalement, nous sommes encore incapable de cultiver certaines cellules
eucaryotes hôtes importantes.
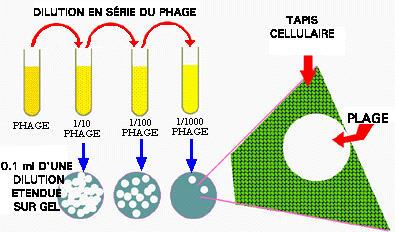
Figure 12. Test par plage de lyse (plaque assay). Une suspension de phage est diluée en série et des échantillons de quelques dilutions sont mélangés avec des hôtes cellulaires sur un plat d'agar. Des plages de lyse se formeront au fur et a mesure que les virus vont se propager de cellules en cellules. Puisque le nombre de plages représente le nombre de virus initialement présent dans le plat, on peut en déduire le titre viral de l'échantillon.