DÉPARTEMENT DE GÉNIE CHIMIQUE
BCM 20329: INTRODUCTION AU GÉNIE BIOCHIMIQUE
![]() 1D - PROTÉINES ET ENZYMES
1D - PROTÉINES ET ENZYMES![]()
- QUESTIONS
(CHAPITRE 7 DE HURLBERT)
- LES
PRINCIPALES CARACTÉRISTIQUES DES PROTÉINES ET DES ENZYMES
- LES
DIFFÉRENTS TYPES D'INHIBITION
- UN PREMIER
CAS DE CINÉTIQUE ENZYMATIQUE: le modèle de Michaelis-Menten
![]() Structures primaire
à quaternaire des protéines
Structures primaire
à quaternaire des protéines
Structure primaire: séquence des acides aminés
Par exemple, une partie de la séquence de l'hexokinase de la levure S. cerevisiae:
- 1 AASXDXSLVEVHXXVFIVPPXILQAVVSIA
- 31 TTRXDDXDSAAASIPMVPGWVLKQVXGSQA
- 61 GSFLAIVMGGGDLEVILIXLAGYQESSIXA
- 91SRSLAASMXTTAIPSDLWGNXAXSNAAFSS
- 121XEFSSXAGSVPLGFTFXE AGAKEXVIKGQI
- 151 TXQAXAFSLAXLXKLISAMXNAXFPAGDXX
- 181 XXVADIXDSHGILXXVNYTDAXIKMGIIFG
- 211 SGVNAA
Structure secondaire: patron répétitif
L'hélice alpha (pont H tous les 4 a.a., a.a. hydrophobes):
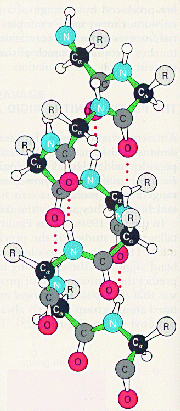
Le feuillet beta:
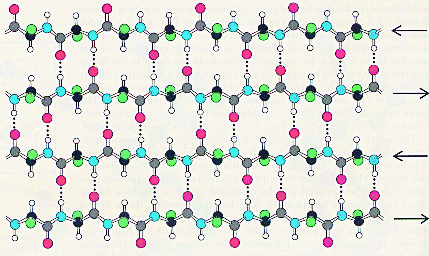
Structure tertiaire: forme 3-D
Par exemple, l'hexokinase mentionnée précédemment:

Structure quaternaire: assemblage de sous-unités
Par exemple, l'hemoglobine est composée de 4 polypeptides, dont 2 sous-unités alpha et 2 sous-unités beta:

Aussi: la modification post-traductionnelle
- Glycosylation
- Phosphorylation
- Pont S
![]() Pour en
savoir plus sur les modifications post-traductionnelles, cliquez
ici (Cours BIOSCI99A, Harmut Luecke, University of California, Irvine)
Pour en
savoir plus sur les modifications post-traductionnelles, cliquez
ici (Cours BIOSCI99A, Harmut Luecke, University of California, Irvine)
![]() Différents
rôles des protéines
Différents
rôles des protéines
- structure
- récepteurs
- transporteurs
- enzymes
![]() LES
ENZYMES
LES
ENZYMES
Une enzyme agit comme un catalyseur afin d'accélérer la transformation d'un substrat en produit.
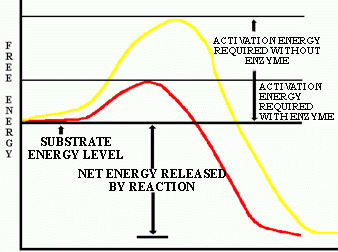
![]() Si une bactérie thermophile (vivant à température
moyenne) et une psychrophile (vivant à température très froide) ont chacune une
enzyme qui agissent sur la même réaction, laquelle des 2 abaisserait le plus
l'énergie d'activation?
Si une bactérie thermophile (vivant à température
moyenne) et une psychrophile (vivant à température très froide) ont chacune une
enzyme qui agissent sur la même réaction, laquelle des 2 abaisserait le plus
l'énergie d'activation?
![]() Différents types d'enzymes (suffixe -ase)
Différents types d'enzymes (suffixe -ase)
- protéase
- lipase
- DNase
- kinase
(ajoute un phosphate)
- oxydase
- réductase,
etc
![]() Caractéristiques des enzymes
Caractéristiques des enzymes
![]() spécificité (mécanisme clé-serrure)
spécificité (mécanisme clé-serrure)
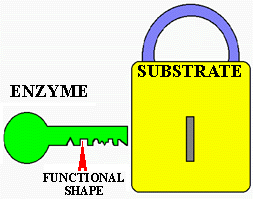
![]() grande taille par rapport au substrat
grande taille par rapport au substrat
![]() rapidité
rapidité
![]() déformabilité
déformabilité
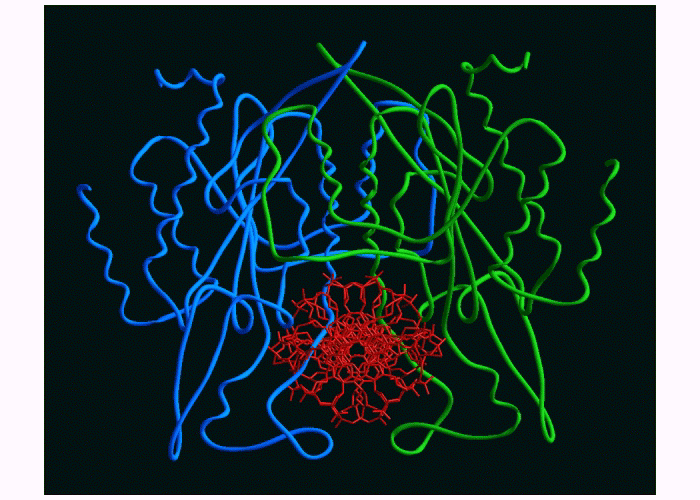
(EcoR1 autour de l'ADN)
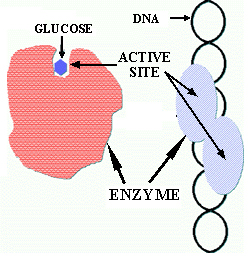
![]() Mode d'action: interaction avec le site actif = site spécifique de la réaction
Mode d'action: interaction avec le site actif = site spécifique de la réaction
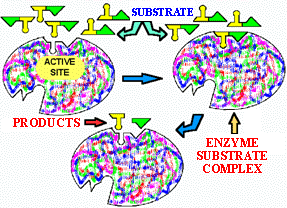
E + S <===> E.S ====> E + P
![]() Pourquoi n'y aurait-il-pas plusieurs
sites spécifiques sur une même enzyme?
Pourquoi n'y aurait-il-pas plusieurs
sites spécifiques sur une même enzyme?
![]() À proximité du site actif: les co-facteurs (composant
non-protéique, essentiel à l'activité enzymatique)
À proximité du site actif: les co-facteurs (composant
non-protéique, essentiel à l'activité enzymatique)
![]() à liaison forte: groupes prosthétiques.
En général des cations métalliques. ex: les atomes de Fe dans l'hémoglobine,
les métallo-protéases.
à liaison forte: groupes prosthétiques.
En général des cations métalliques. ex: les atomes de Fe dans l'hémoglobine,
les métallo-protéases.
![]() à liaison faible:
contribuent à la réaction. Ex: vitamines, transporteurs d'éléctrons (NAD+,
FAD), transporteurs d'énergie (AMP, ADP, ATP, GTP, etc)
à liaison faible:
contribuent à la réaction. Ex: vitamines, transporteurs d'éléctrons (NAD+,
FAD), transporteurs d'énergie (AMP, ADP, ATP, GTP, etc)
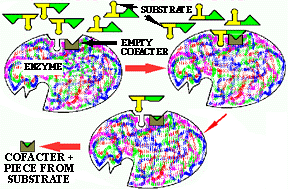
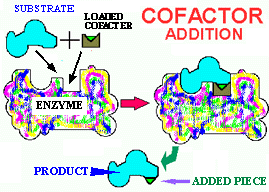
![]() apoenzyme
+ co-facteur = holoenzyme
apoenzyme
+ co-facteur = holoenzyme
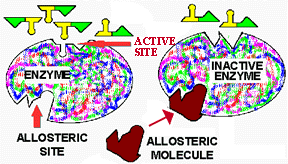
![]() Autre
site spécifique: site allostérique
Autre
site spécifique: site allostérique
molécule qui s'y
attachera: effecteur allostérique,
qui aura un effet allostérique sur
l'enzyme en modifiant la forme de la protéine et spécialement du site
actif. Peut avoir un effet positif ou négatif (inhibition).
![]() Inhibition enzymatique
Inhibition enzymatique
![]() Thermique: > 60C, dénaturation de la plupart des
protéines
Thermique: > 60C, dénaturation de la plupart des
protéines
![]() Chimique: irréversible(empoisonnement)
ou réversible(joue alors souvent un rôle
de régulation)
Chimique: irréversible(empoisonnement)
ou réversible(joue alors souvent un rôle
de régulation)
![]() Inhibition compétitive: l'inhibiteur
se lie au site actif, c'est un analogue du
substrat.
Inhibition compétitive: l'inhibiteur
se lie au site actif, c'est un analogue du
substrat.
![]() irréversible, ex:
certains agents thérapeutiques
irréversible, ex:
certains agents thérapeutiques
![]() réversible:
réversible:
- E +S <===> (E·S) ===> E + P
- E + I <===> (E·I)
![]() Inhibition non-compétitive
Inhibition non-compétitive
![]() non-spécifique et
irréversible: destruction totale (par métaux lourds: Pb, Hg, Cd, Ni, ou
cyanure, CO, etc)
non-spécifique et
irréversible: destruction totale (par métaux lourds: Pb, Hg, Cd, Ni, ou
cyanure, CO, etc)
![]() spécifique et réversible:
spécifique et réversible:
- E
+ S <===> (E·S) ===> E + P
- E
+ I <===> (E·I)
- (E·I) + S <===> (E·I·S)
- (E·S) + I <===> (E·I·S)
- donc
fonction de la concentration des espèces et des constantes
cinétiques
![]() Autres modes de régulation:
Autres modes de régulation:
![]() les protéases
les protéases
![]() la concentration en enzymes (régulation de
l'expression)
la concentration en enzymes (régulation de
l'expression)
![]() Étude des
protéines et des enzymes
Étude des
protéines et des enzymes
![]() Étapes:
Étapes:
- récupération
- séparation
- purification
- Étude: propriétés générales (Masse moléculaire (PM),
Point Isoélectrique (PI), digestion enzymatique), activité
- Le PM peut être déterminer par électrophorèse ou
spectroscopie de masse
- Le point isoélectrique est le pH auquel une molécule
aura une charge nette nulle
- La digestion enzymatique avec une enzyme
particulière (par exemple la trypsine) qui générera un patron
de peptides spécifique
- L'activité enzymatique se mesure par la vitesse de
dégradation du substrat ou de génération du produit qui lui sont
spécifiques
![]() EXEMPLES
EXEMPLES
La trypsine de rat
- Informations sur EXPASY (www.expasy.org) avec les mots-clés "rat trypsin anionic"
- Description dans la section "comments"
- Activité catalytique: coupe Arg-X et Lys-X (R et K)
- Caractéristiques
- Séquence
- Forme 3D (trypsine, trypsine.zip)
![]() L'albumine humaine
L'albumine humaine
- Informations sur EXPASY avec les mots clés "albumin human"
- No d'accession(P02768)
- Fonction
- Gel 2D
- Caractéristiques: structures secondaires, groupes prosthétiques ou cofacteurs, glycosylation (N- linked, glucides liés à l'asparagine, ou O- linked, liés à la sérine, la thréonine ou la cystéine), phosphorylation (sur la sérine, la thréonine ou moins fréquemment la tyrosine) etc.
- Séquence
- PM et PI (utilisation de l'outil "protparam")
- Peptides générés suite à une digestion (utilisation des outils de protéomiques "peptide cutter" et "peptide mass" dans EXPASY (http://ca.expasy.org/tools/)
- Forme 3-D (albumine, albumine.zip)
Copyright
© A. Garnier, 2001 Ce matériel peut être utilisé à des fins pédagogiques
uniquement. Aucun droits de reproduction à des fins commerciales.